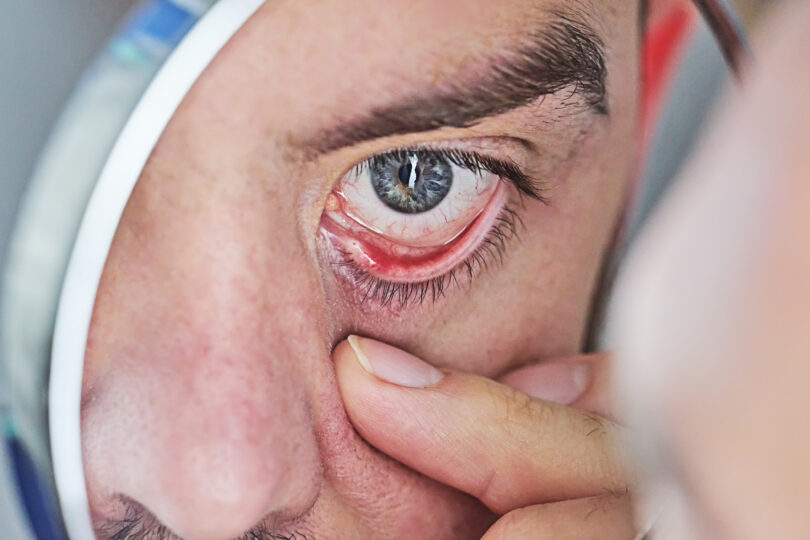
Em junho de 2023, a Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do medicamento TEPEZZA® (teprotumumabe) como tratamento da Doença Ocular da Tireoide, também conhecida como Orbitopatia de Graves, na sua forma ativa. Mas, o que devemos saber sobre essa medicação?
A Orbitopatia de Graves (OG) é uma doença autoimune rara e debilitante, com uma incidência de 1,9 casos por 10.000 habitantes por ano. O curso da doença transita de um período ativo progressivo caracterizado por inflamação para um período estável e fibrótico (inativo) após 1 a 3 anos. A remodelação da órbita e da face superior resulta em diversas apresentações, incluindo olhos secos, aumento do lacrimejamento, irritação local e retração palpebral em casos leves, mas também pode se manifestar como pronunciada proptose, diplopia (devido à restrição irregular da motilidade) e compressão do nervo óptico, com potencial perda de visão em doenças mais graves.
Os agentes imunomoduladores podem reduzir a inflamação na doença ativa, mas têm efeitos limitados nas sequelas de longo prazo da doença ocular da tireoide, como desfiguração e incapacidade por proptose e diplopia, que prejudicam a qualidade de vida. Pacientes com doença grave geralmente necessitam de múltiplas medidas corretivas. procedimentos cirúrgicos (por exemplo, descompressão orbital, correção de estrabismo e reparo de pálpebras).
O teprotumumabe é um anticorpo monoclonal, antagonista do receptor de IGF-1, que inibe a sinalização do receptor. Presume-se que, ao bloquear a ativação do IGF-1R, o teprotumumabe previne a sinalização através dos complexos IGF-1R/TSHR, inibindo assim a ativação autoimune. Estudos baseados em células indicam que o teprotumumabe inibe o crosstalk de IGF-1R/TSHR em fibroblastos orbitais.
Em ensaios clínicos de fase II e III em adultos com OG ativa moderada a grave, o teprotumumabe intravenoso melhorou significativamente a proptose e uma série de outros resultados, incluindo taxa de resposta global, Clinical Activity Score (CAS), diplopia e qualidade de vida. O benefício clínico do teprotumumabe manteve-se até 51 semanas após o tratamento na maioria dos pacientes. O agente foi geralmente bem tolerado; os eventos adversos com a maior diferença de risco em comparação com o placebo foram espasmos musculares, perda auditiva e hiperglicemia.
O teprotumumabe é administrado como infusão intravenosa a cada 3 semanas, totalizando oito infusões. A primeira dose é administrada a 10 mg/kg de peso corporal com as sete infusões seguintes administradas a 20 mg/kg. O tempo de infusão é inicialmente de 90 minutos, que pode ser reduzido para 60 minutos após as duas primeiras infusões se o teprotumumabe for bem tolerado.